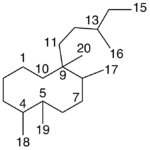
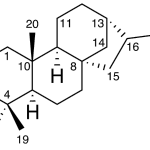
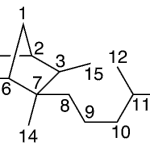
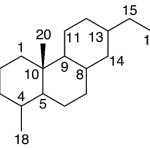
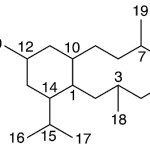
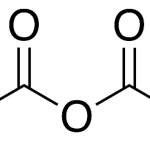
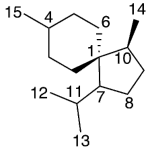
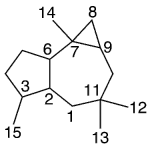
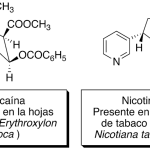
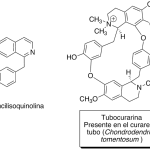
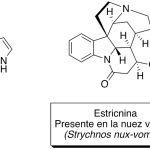
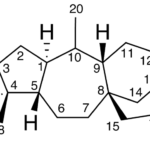
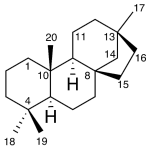
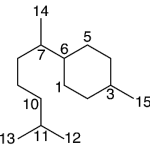
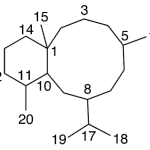
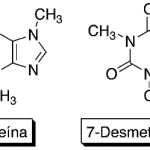
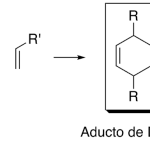
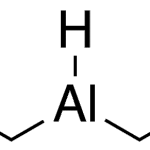
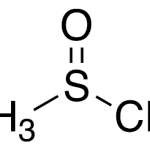
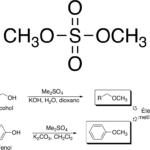
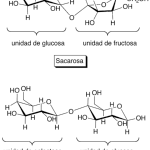
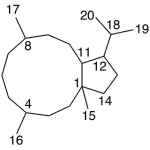
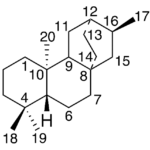
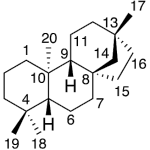
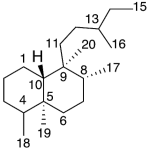
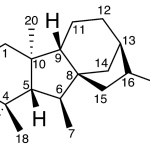
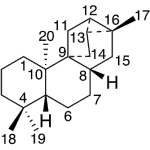
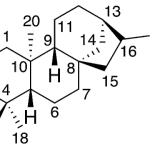
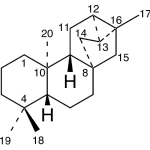
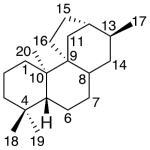
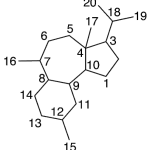
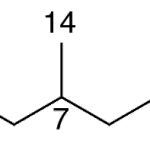
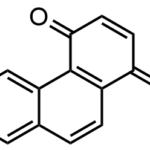
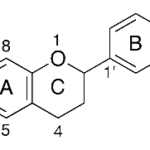
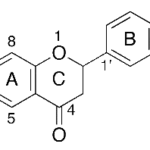
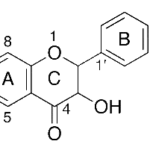
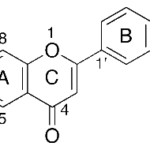
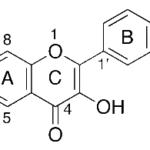
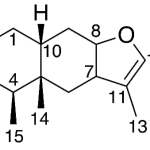
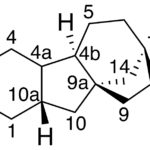
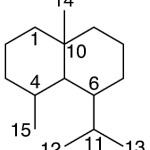
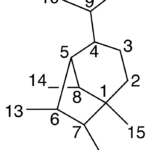
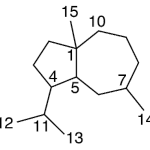
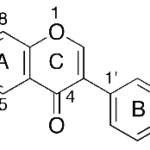
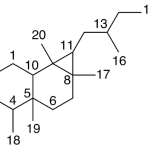
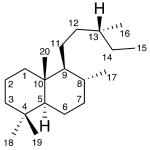
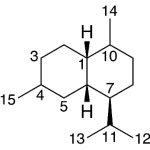
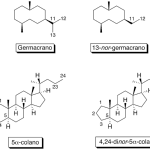
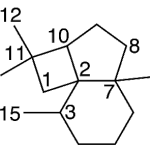
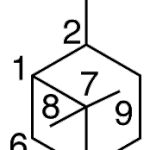
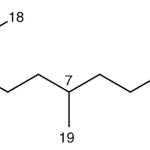
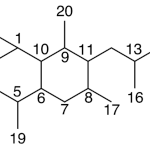
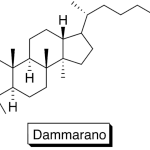
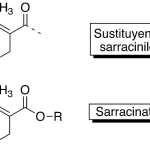
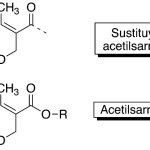
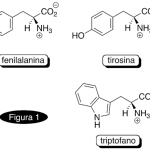
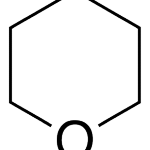
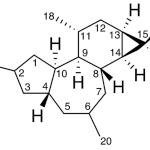
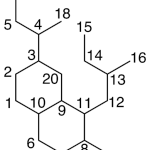
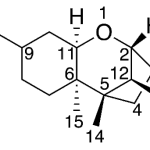
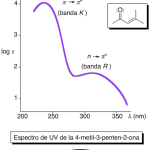
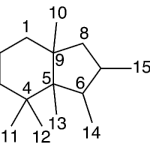
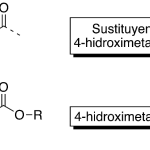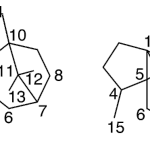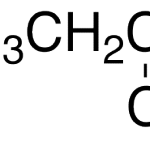| Cacalol | Sustancia que posee una estructura molecular básica similar a la imagen.
En inglés su nombre se escribe igual que en español.
| 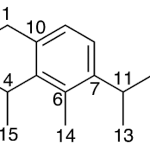 |
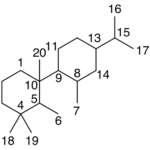
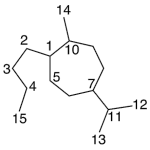
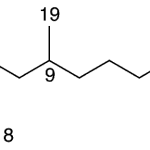
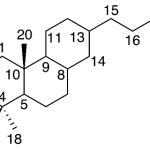
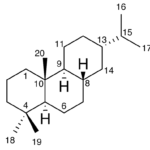
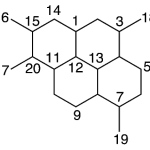
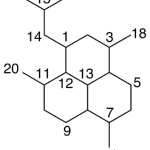
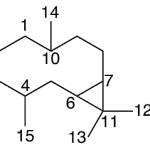
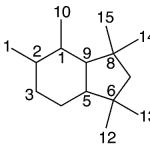
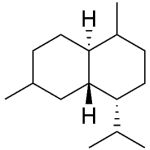
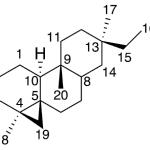
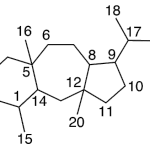
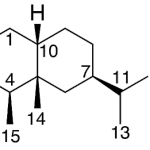
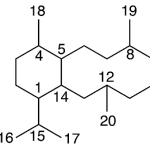
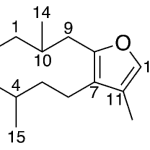
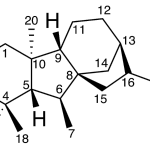
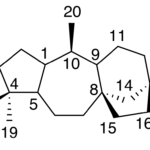
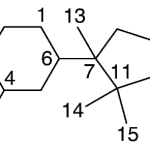
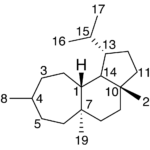
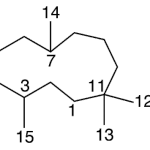
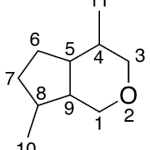
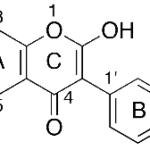
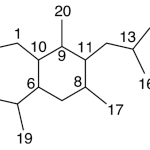
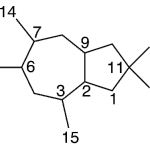
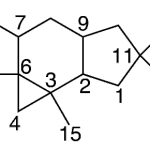
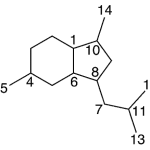
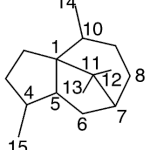
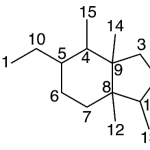
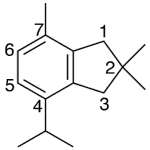
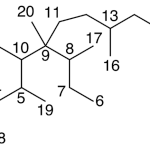
| Cadaleno | Sustancia que posee una estructura molecular básica similar a la imagen.
En inglés: cadalene.
|  |
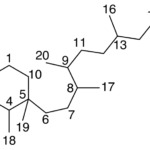
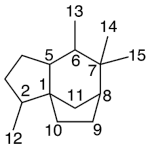
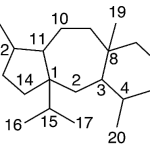
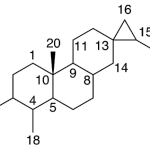
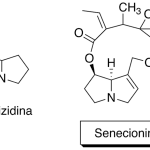
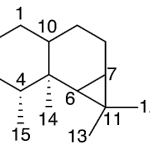
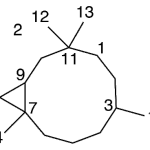
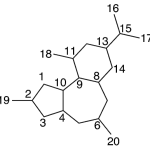
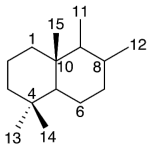
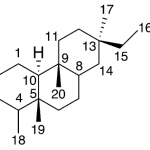
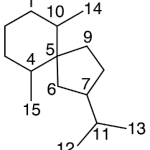
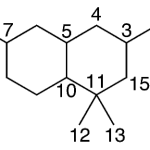
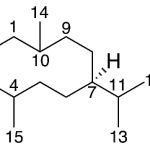
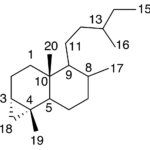
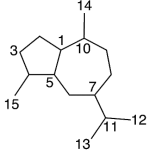
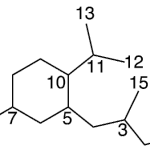
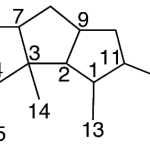
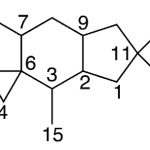
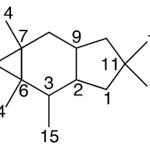
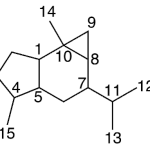
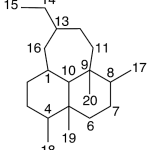
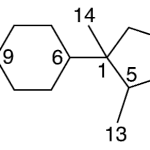
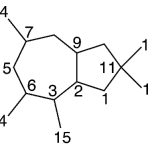
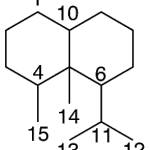
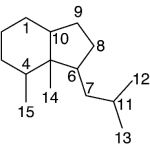
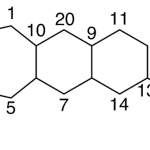
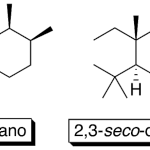
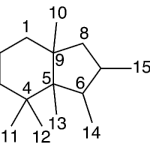
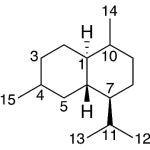
| Cadinano | Sustancia que posee una estructura molecular básica similar a la imagen.
En inglés: cadinane.
|  |
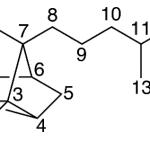
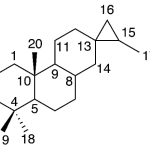
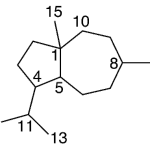
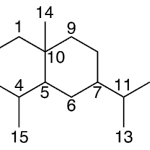
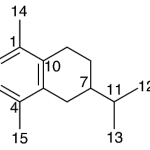
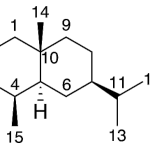
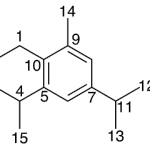
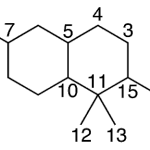
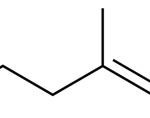
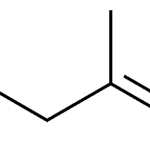
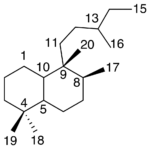
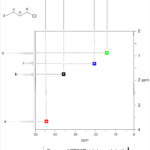
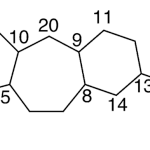
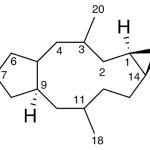
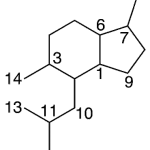
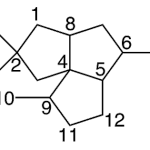
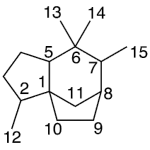
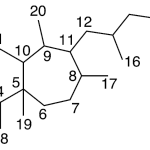
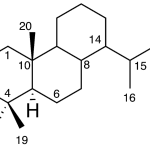
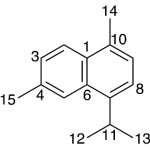
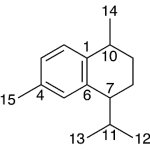
| Calameneno | Sustancia que posee una estructura molecular básica similar a la imagen.
En inglés: calamenene.
|  |
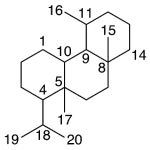
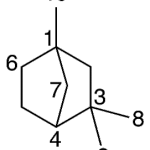
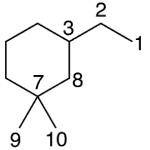
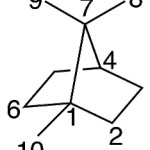
| Canfano | Sustancia que posee una estructura molecular básica similar a la imagen.
En inglés: camphane.
|  |
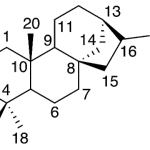
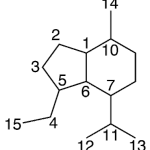
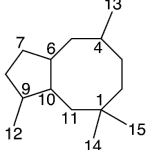
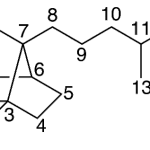
| Canferenano | Sustancia que posee una estructura molecular básica similar a la imagen.
En inglés: campherenane.
|  |
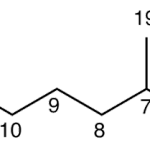
| Capnelano | Sustancia que posee una estructura molecular básica similar a la imagen.
En inglés: capnellane.
| 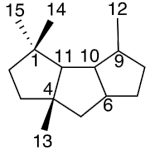 |
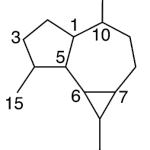
| Carabrano | Sustancia que posee una estructura molecular básica similar a la imagen.
En inglés: carabrane.
| 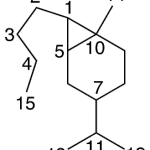 |
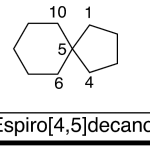
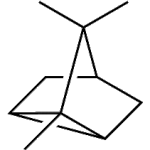
| Carano | Sustancia que posee una estructura molecular básica similar a la imagen.
En inglés: carane.
| 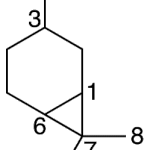 |
| Cardiotónico | Sustancia que aumenta la fuerza de contracción del corazón, con lo que el funcionamiento de este órgano mejora.
En inglés: cardiotonic.
| |
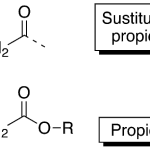
| Cariofilano | Sustancia que posee una estructura molecular básica similar a la imagen.
En inglés: caryophyllane.
|  |
| Carminativo | Sustancia que favorece la expulsión de gases del tracto gastrointestinal.
En inglés: carminative.
| |
| Carotenoides | Producto de condensación isoprénica de 40 átomos de carbono con ocho unidades isoprénicas (v.). No cumplen con la regla del isopreno (v.). Puede llamárseles tetraterpenos. Constituyen pìgmentos rojos o amarillos ampliamenrte distribuidos en el mundo vegetal. Algunos son importantes dado que son precursores de la vitamina A, como el β-caroteno. Las investigaciones que desarrolló Paul Karrer (1889-1971) sobre este tipo de compuestos, entre otros estudios, le valió el Premio Nobel de Química en 1937. Para nombrarlos formalmente, se toma en consideración el esqueleto carbonado presente en uno y otro extremo de la cadena y se asignan dos letras griegas en función de cuáles de éstos se hallan presentes.
En inglés: carotenoids.
| 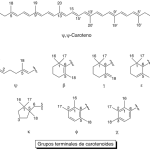 |
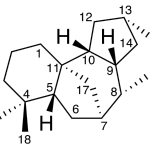
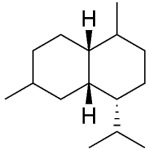
| Casano | Sustancia que posee una estructura molecular básica similar a la imagen.
En inglés: casane.
| 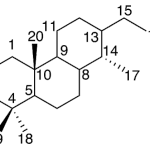 |
| Casbano | Sustancia que posee una estructura molecular básica similar a la imagen.
En inglés: casbane.
| 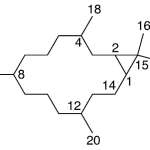 |
| Catártico | v. Purgante
| |
| CD | v. Dicroísmo circular
| |
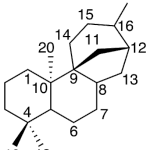
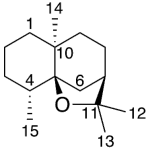
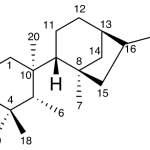
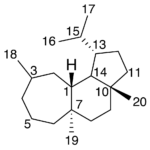
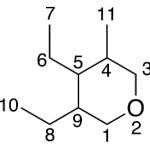
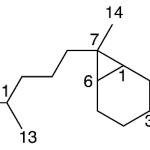
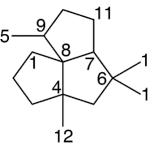
| Cedrano | Sustancia que posee una estructura molecular básica similar a la imagen.
En inglés: cedrane.
| 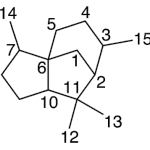 |
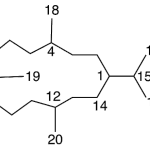
| Cembrano | Sustancia que posee una estructura molecular básica similar a la imagen.
En inglés: cembrane.
|  |
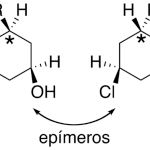
| Centro asimétrico | v. Centro de quiralidad
| |
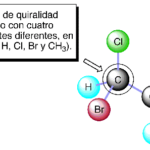
| Centro de quiralidad | Átomo unido a cuatro sustituyentes distintos entre sí dispuestos hacia los vértices de un tetraedro imaginario en cuya posición central se encuentra ubicado dicho átomo. En los compuestos orgánicos normalmente este último es un carbono con hibridación sp³, y puede haber varios de ellos en una sola molécula. Anteriormente recibió los nombres de estereocentro, centro quiral, centro asimétrico y centro estereogénico (i. e. carbono quiral, carbono asimétrico, carbono estereogénico; no puede hablarse de “carbono de quiralidad”).
En inglés: chirality center.
|  |
| Centro estereogénico | v. Centro de quiralidad
| |
| Centro quiral | v. Centro de quiralidad
| |
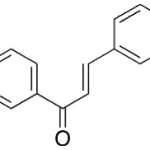
| Chalcona | Sustancia que posee una estructura molecular básica similar a la imagen .
En inglés: chalcone.
|  |
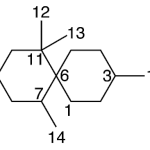
| Chamigrano | Sustancia que posee una estructura molecular básica similar a la imagen.
En inglés: chamigrane.
|  |
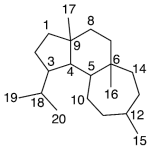
| Ciatano | Sustancia que posee una estructura molecular básica similar a la imagen.
En inglés: cyathane.
|  |
| Cicatrizante | Sustancia que favorece el cierre y sanación de las heridas.
En inglés: cicatrizant.
| |
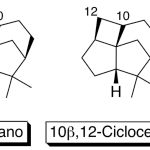
| Ciclo | En la química de productos naturales, prefijo en el nombre de una sustancia que indica que la molécula cuenta con un anillo que se halla ausente en la de la estructura original.
En inglés: cyclo.
|  |
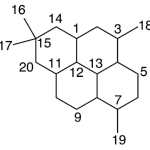
| Cicloanfilectano | Sustancia que posee una estructura molecular básica similar a la imagen.
En inglés: cycloamphilectane.
|  |
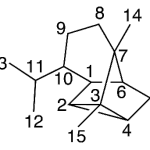
| Ciclocopacanfano | Sustancia que posee una estructura molecular básica similar a la imagen.
En inglés: cyclocopacamphane.
|  |
| Cicloeudesmano | Sustancia que posee una estructura molecular básica similar a la imagen.
En inglés: cycloeudesmane.
| 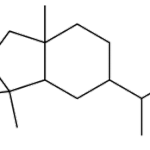 |
| Ciclofarnesano | Sustancia que posee una estructura molecular básica similar a la imagen.
En inglés: cyclofarnesane.
| 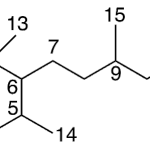 |
| Ciclofarnesano transpuesto | Sustancia que posee una estructura molecular básica similar a la imagen.
En inglés: rearranged cyclofarnesane.
| 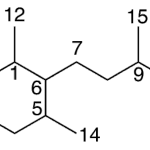 |
| Ciclolaurano | Sustancia que posee una estructura molecular básica similar a la imagen.
En inglés: cyclolaurane.
| 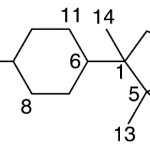 |
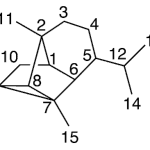
| Ciclosinularano | Sustancia que posee una estructura molecular básica similar a la imagen.
En inglés: cyclosinularane.
|  |
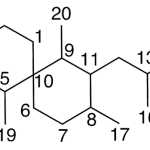
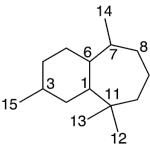
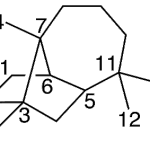
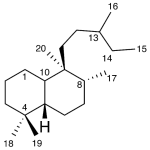
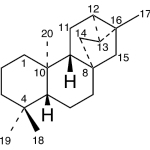
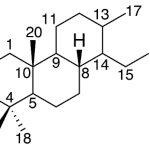
| Cleistantano | Sustancia que posee una estructura molecular básica similar a la imagen.
En inglés: cleistanthane.
|  |
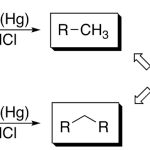
| Clemmensen, reducción de | Reacción de reducción (v.) del grupo carbonilo (CO) de un aldehido o cetona por acción de zinc amalgamado en ácido clorhídrico (v.).
En inglés: Clemmensen reduction.
|  |
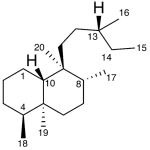
| Clerodano | Sustancia que posee una estructura molecular básica similar a la imagen.
En inglés: clerodane.
|  |
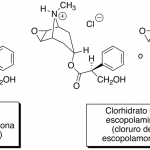
| Clorhidrato | Sal derivada de una sustancia protonada con ácido clorhídrico. Este método se utiliza ampliamante para estabilizar moléculas de alcaloides.
En inglés: hydrochloride.
|  |
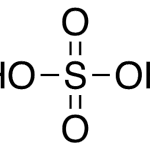
| Clorhídrico, ácido | Nombre que reciben las soluciones acuosas de cloruro de hidrógeno. La comercialmente saturada se encuentra al 38% en masa. Es fuertemente ácida y corrosiva. Produce lesiones muy severas sobre la piel. Fórmula = HCl(ac). M = 36.46 g/mol. La solución saturada funde aproximadamente a -25 ºC y hierve a 108 ºC (760 mmHg) en forma de un azeótropo con el agua que contiene 20.22% de HCl. Densidad = 1.19 g/cm³. No es inflamable. Desprende humos de HCl gas sumamente irritantes y dañinos a las mucosas; puede causar colapso a las vías respiratorias. Sus desechos deben ser neutralizados antes de ser liberados al ambiente. Se emplean frecuentemente soluciones diluidas de esta sustancia en la extracción de alcaloides. Nombre alternativo: ácido muriático (informal, nunca debe usarse en la redacción científica).
En inglés: hydrochloric acid, hydrogen chloride aqueous solution.
| |
| Cloroformo | Disolvente líquido de olor penetrante dulce, cada vez menos empleado como disolvente debido a su poder carcinogénico. Puede generar cirrosis. Fórmula = CHCl3. M = 119.38 g/mol. Funde a -63 ºC y hierve a 61 ºC (760 mmHg). Densidad = 1.492 g/cm³ (25 ºC). No es inflamable. Polaridad apreciable. Relativamente poco soluble en agua. Sus vapores ocasionan narcosis. Sus desechos no pueden ser liberados al ambiente, ya que contaminan severamente el medio acuático y atmosférico (sus emanaciones en las capas altas de la atmósfera destruyen la capa de ozono). Se recomienda muy ampliamente emplear siempre alternativas para evitar su uso. Nombre alternativos: triclorometano, cloruro de metilidino (muy raramente).
En inglés: chloroform.
| |
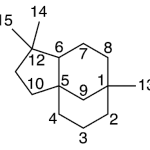
| Clovano | Sustancia que posee una estructura molecular básica similar a la imagen.
En inglés: clovane.
|  |
| Colagogo | Sustancia que facilita la secreción de bilis al duodeno.
En inglés: cholagogue.
| |
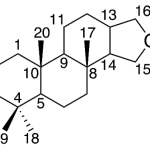
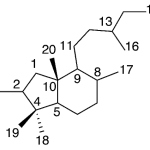
| Colensano | Sustancia que posee una estructura molecular básica similar a la imagen.
En inglés: colensane.
|  |
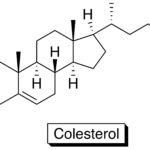
| Colesterol | El principal esterol de los animales superiores. Fórmula: C27H46O. M = 386.64 g/mol. Funde a 148 ºC (anhidro) y hierve a 360 ºC con algo de descomposición. Densidad: 1.2 g/cm3 (para el monohidrato). Se halla presente en todos los tejidos corporales (componente principal de todas las membranas biológicas), especialmente en el cerebro (donde aproximadamente el 25 % de los lípidos presentes es colesterol), en la médula espinal y en las grasas y aceites animales. Prácticamente insoluble en agua, soluble ligeramente en alcohol, apreciablemente soluble en éter, cloroformo, benceno, piridina. Es el principal componente de los cálculos biliares. En plantas se ha identificado en los aceites de coco, de semilla de algodón, de soya, de maíz, de cacahuate, de aguacate, de oliva, etc. En plasma sanguíneo el colesterol total debe ser menor a 200 mg/dL. Los niveles excesivos producen aterosclerosis (con afectación a corazón, cerebro, arterias periféricas), en comorbilidad con diabetes mellitus, obesidad, hipertensión arterial y enfermedad vascular cerebral. Los términos de colesterol bueno y colesterol malo no están referidos al compuesto en sí, sino a las lipoproteínas de alta densidad (HDL por sus siglas en inglés) y a las lipoproteínas de baja densidad (LDL), respectivamente. El “colesterol bueno” contiene escaso contenido de lípidos e interviene en el transporte de triglicéridos y del colesterol mismo de la circulación sanguínea hacia el hígado para su metabolismo, y desde éste nuevamente de regreso a torrente sanguíneo para su utilización en tejido muscular y adiposo. El “colesterol malo” o aterogénico (el cual, hasta en un 25 %, se obtiene por vía exógena, esto es, desde los alimentos) se sintetiza de manera endógena en el hígado; por sí mismas, estas lipoproteínas no tienen efecto nocivo, y su función consiste en transportar colesterol a los tejidos del organismo, pero si se encuentran en exceso pueden acumularse en las paredes de las arterias y obstruirlas. Los límites máximos permitidos son para HDL >40 mg/dL en hombres, >50 mg/dL en mujeres; para las LDL 150 mg/dL. No obstante, debe enfatizarse que diversos cuerpos colegiados se reúnen periódicamente para revisar estas cifras debido a que se encuentran en constante cambio, como consecuencia de los cambios en los hábitos alimenticios humanos. Hasta hace algunos años se consideraba que cifras bajas de estas lipoproteínas eran la causa de diversas enfermedades; actualmente esto se ha descartado debido al alto indice de obesidad, de diabéticos, cardiópatas, de pacientes con síndrome metabólico y con enfermedades tiroideas. Los principales alimentos con alto contenido de colesterol son la leche entera y sus derivados, huevo, carnes rojas, mariscos, coco, etc. No hay enfermedades hoy descritas como consecuencia de una deficiencia de colesterol. Nombres alternativos: 5-colesten-3β-ol, colest-5-en-3β-ol, colesterina, 3β-hidroxi-5-colesteno.
En inglés: cholesterol.
|  |
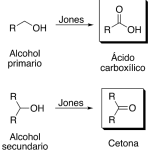
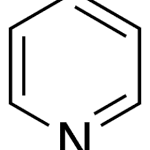
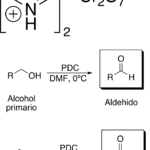
| Collins, oxidación de | Proceso que se lleva a cabo con una mezcla de piridina (v.) y trióxido de cromo (v.) en la que los alcoholes primarios se transforman en aldehídos y los secundarios en cetonas. Los alcoholes terciarios no son atacados bajo estas condiciones. Se deben observar precauciones dentro de este proceso (el trióxido de cromo debe adicionarse cuidadosamente a la piridina y no al revés, para evitar un riesgo de incendio).
En inglés: Collins oxidation.
| 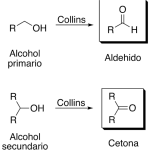 |
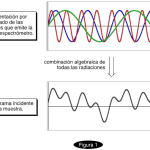
| COLOC | Acrónimo del experimento de “Espectroscopia de correlación para acoplamientos a larga distancia” (COrrelated spectroscopy for Long-range Couplings). Se trata de una técnica analítica obsoleta que se llevaba a cabo en un equipo de resonancia magnética nuclear (v.) actualmente ha sido reemplazada por el experimento HMBC (v.). Consistía en detectar acoplamientos entre los átomos de hidrógeno y de carbono en una molécula pero solamente si entre ellos había dos y tres enlaces. La información de estos acoplamientos se expresaba en un diagrama bidimiensional a manera de un sistema de coordenadas representando en los ejes cartesianos los espectros de resonancia magnética nuclear de hidrógeno-1 y de carbono-13 de la muestra.
| |
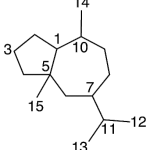
| Coloratano | Sustancia que posee una estructura molecular básica similar a la imagen.
En inglés: coloratane.
| 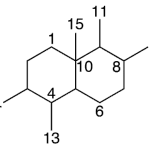 |
| Configuración absoluta | Descriptor estereoquímico de un centro de quiralidad (v.) que permite definir inequívocamente la orientación en el espacio exacta que guardan sus cuatro sustituyentes diferentes. El descriptor es una letra, R o S (de rectus, derecho, y sinister, izquierdo) y su asignación se hace con base en una serie de criterios (llamadas “reglas o notación de Cahn-Ingold-Prelog”) que dependen únicamente de la arquitectura molecular presente, no de la comparación con algún otro sistema (v. configuración relativa).
En inglés: absolute configuration.
| |
| Configuración relativa | Descripción de la orientación exacta en el espacio que guardan algunos de los sustituyentes de una molécula, o incluso de la forma de la molécula en su totalildad, en términos comparativos con algún otro sistema con el que haya una relación estructural estrecha. Un ejemplo contra el cual se puede realizar la comparación es con una molécula que posea diferencias estructurales mínimas, como un sólo sustituyente distinto con respecto a la original; otro caso es el de una molécula de constitución idéntica pero con diferencias en la orientación en el espacio de sus grupos (estereoisomería). La comparación puede realizarse incluso entre diferentes partes de la misma molécula que se analiza. No confundir este término con el de configuración absoluta (v.).
En inglés: relative configuration.
|  |
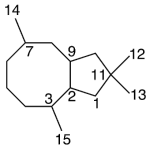
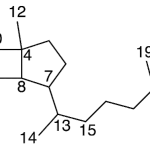
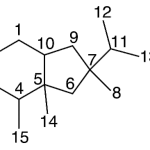
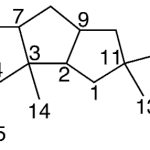
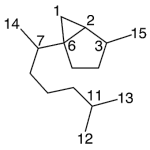
| Copaano | Sustancia que posee una estructura molecular básica similar a la imagen.
En inglés: copaane.
| 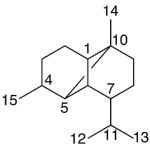 |
| Copacanfano | Sustancia que posee una estructura molecular básica similar a la imagen.
En inglés: copacamphane.
| 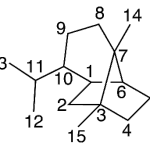 |
| Correlación, espectroscopía de | v. COSY
| |
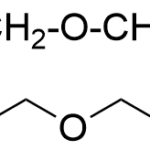
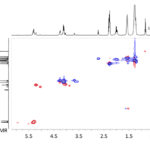
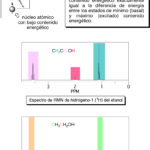
| COSY | Acrónimo del experimento analítico denominado “Espectroscopía de correlación” (COrrelation SpectroscopY) llevado a cabo en un equipo de resonancia magnética nuclear (v.). Con esta técnica es posible obtener un diagrama en el que pueden identificarse fácilmente, para cada uno de los átomos de hidrógeno presentes en las moléculas de una muestra, todos los acoplamientos que presenten con otros átomos de hidrogeno. Normalmente, en este experimento los acoplamientos que se detectan son aquellos que se presentan entre hidrógenos a los cuales los separan dos y tres enlaces. El diagrama consiste en una representación de dos espectros de resonancia magnética nuclear de hidrógeno-1 (RMN de 1H) trazándose uno de ellos sobre el eje de las ordenadas y otro en el de las abscisas; en un cuadro que aparece a un costado de ellos se representan una serie de trazos a manera de manchas, cada una de las cuales relaciona los hidrógenos que presentan el fenómeno del acoplamiento a manera de un sistema de coordenadas. Considérese por ejemplo el diagrama del experimento COSY para el éter etil propílico que se representa en la Figura. Los acoplamientos entre hidrógenos separados por dos enlaces (geminales) forman una banda de trazos en diagonal (aquí en forma de cuadros; en realidad, poseen una forma irregular) que en este diagrama se representan en negro. Los acoplamientos vecinales, esto es, entre hidrógenos separados a tres ligaduras (enlazados a carbonos vecinos) se indican a colores, y se representan igualmente como una serie de trazos. Hay tres acoplamientos de este tipo: entre los hidrógenos a y b, entre los c y d y entre los d y e. En ocasiones hay trazos que no se ubican exactamente debajo de ningún hidrógeno del espectro dispuesto horizontalmente o a la misma altura de alguna de las señales del que se ubica en vertical; no deben de ser tomados en cuenta para el análisis. Es posible alcanzar una mejor resolución haciendo uso de la técnica llamada DQF-COSY (de Double Quantum Filtered COSY, experimento COSY de doble filtrado cuántico), en la que se reduce la intensidad de las señales de algunos sustituyentes (como por ejemplo, los grupos metilo CH3 no acoplados); gracias a ello es posible mejorar la apariencia de algunos de los trazos con menor resolución.
|  |
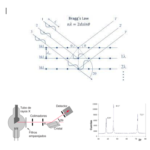
| Cromatografía | Nombre que reciben diferentes técnicas de separación y purificación de mezclas de sustancias (a las que se les denomina eluatos), las cuales son sometidas a una migración a través de un lecho conocido como fase estacionaria. Dicha migración es promovida por un gas o un disolvente -la fase móvil o eluyente-, y para conseguir esto, se hace uso de medios físicos como la capilaridad, por gravedad o a presión, lo que induce el desplazamiento; a este proceso se le denomina elución. Ambas fases deben ser químicamente inertes con las sustancias que se están separando, y debe procurarse mantener un flujo de la fase móvil constante a una temperatura controlada para que la separación se pueda llevar a cabo de manera exitosa y reproducible. La separación está basada en las diferentes afinidades que las sustancias a separar poseen con la fase estacionaria y con la móvil, expresadas como concentraciones de saturación al equilibrio en cada una de ellas; su relación define el coeficiente de partición K (v. Figura superior). Como cada sustancia posee un diferente valor de K, su tránsito a través del lecho cromatográfico operará con una diferente velocidad, induciéndose de esta manera la separación (v. Figura inferior). La afinidad de una sustancia por la fase estacionaria depende de diversos factores, entre ellos la polaridad (v.); de esta manera, las sustancias más polares serán retenidas en mayor medida que las no polares si la fase estacionaria es polar (cromatografía de fase normal, v.); la tendencia es la opuesta si la fase estacionaria es no polar (cromatografía de fase inversa o reversa, v.). Algunas otras técnicas aprovechan otras propiedades, como el peso molecular (cromatografía por exclusión de tamaño o de permeación en gel), o la carga eléctrica (cromatografía de intercambio iónico) para llevar a cabo la separación. Los volúmenes que pueden manejarse de la mezcla dependen de la técnica en cuestión: si el objetivo se limita a conocer el número de componentes que la constituyen, la técnica cromatográfica será definida como analítica, y la cantidad a manejar de la mezcla puede ser de un miligramo o menos; en contraste, si se desea separar cantidades ponderables de los eluatos, la técnica a emplear deberá de alcanzar el nivel de preparativa. Véase también cromatografía de gases, cromatografía en capa delgada y HPLC.
En inglés: chromatography.
|  |
| Cromatografía de gases | Técnica de separación cromatográfica (v. cromatografía) empleada para separar mezclas de sustancias razonablemente volátiles. Existen dos tipos: de gas-sólido (inventada por Cremer en 1951, la cual no ha encontrado gran aplicación) y de gas-líquido (desarrollada al año siguiente por Martin y James). En la primera la mezcla es retenida por adsorción (v.) por la fase estacionaria, y su uso es más bien limitado debido a la retención semipermanente que se ejerce sobre las moléculas polares. En contraste, la segunda (que es la que recibe el nombre común de cromatografía de gases) tiene gran aplicación en diversos campos de la ciencia; en ella el eluato se reparte entre una fase móvil gaseosa y una fase estacionaria líquida que se encuentra inmovilizada sobre la superficie de un sólido inerte o sobre las paredes de un tubo capilar. Actualmente, como fases estacionarias se emplean columnas de sílice fundida (con la apariencia de un tubo muy delgado enrrollado) y como fase móvil helio principalmente, seguido de hidrógeno y nitrógeno (los gases de arrastre). La temperatura y la presión, dos variables importantes en el desempeño, son controladas por el equipo (denominado cromatógrafo de gases) mediante una computadora que tiene incorporada. A la salida del equipo los eluatos son detectados y cuantificados mediante diversos sistemas (los que reciben precisamente el nombre de detectores) que miden una propiedad física de las sustancias que se están separando (índice de refracción, conductividad eléctrica, etc.). En ocasiones, las sustancias se hacen pasar a un espectrómetro de masas (v. espectrometría de masas) para identificar la naturaleza de los diferentes eluatos (técnica que se conoce como gases-masas). El sistema moderno automatizado se encuentra disponible aproximadamente como se le conoce en la actualidad desde el decenio de 1990 y es capaz de separar cientos de sustancias que formen parte de una mezcla en un sólo ensayo, y cuntificarlas en cantidades tan pequeñas como 1 parte en mil millones. Los resultados de la separación normalmente se expresan en terminos de un diagrama denomiado cromatograma (v.).
En inglés: gas chromatography.
| 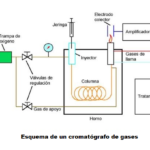 |
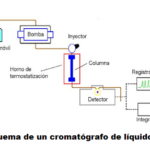
| Cromatografía de liquidos | Técnica de separación cromatográfíca (v. cromatografía) en la que la fase estacionaria es un sólido pulverizado (como gel de sílice) que se dispone dentro de una columna o cilindro de vidrio, y la fase móvil es un disolvente (o eluyente), el cual migra hacia abajo gravitatoriamente, impulsado a presión por alguna bomba de baja presión o mediante succión con vacío, separándose de esta manera los diferentes componentes de la mezcla que ingresan por la parte superior. Este método clásico es la base de separaciones mucho más eficientes llevadas a cabo con instrumentación mediante técnicas como la de HPLC (v.), pero debido a la posibilidad de efectuar separaciones con mezclas del orden de kilogramos incluso (esto es, se trata de un método preparativo), la técnica continúa siendo la primera de elección. La optimización del proceso de separación se lleva a cabo realizando análisis cualitativos con placas de cromatografía en capa delgada (v.), que reproducen en gran medida el comportamiento que la mezcla tendrá en la columna. La composición de la fase móvil puede ser única a lo largo de toda la separación (en cuyo caso la separación se define como isocrática; a veces a esta técnica se le llama cromatografía relámpago o flash) o bien los disolventes empleados pueden ir variando su composición hacia mezclas con mayor polaridad (si la fase estacionaria es normal, v. fase normal) o hacia menor polaridad (si la fase estacionaria es inversa o reversa, v.).
En inglés: liquid chromatography.
|  |
| Cromatografía en capa delgada | Técnica cromatográfica (v. cromatografía) empleada en la separación, identificación y cuantificación de los componentes de una mezcla de sustancias (en solución) en la cual se hace uso de un lecho constituido por un sólido finamente pulverizado (que opera como la fase estacionaria) dispuesto o inmovilizado sobre una placa plana ordinariamente de forma cuadrangular o rectangular, hecha de vidrio, aluminio o plástico. La separación se lleva a cabo colocando una gota de la solución que porta la mezcla a una distancia de aproximadamente 1 cm de uno de los costados de la placa, sin permitir que se extienda más allá de un par de milímetros de diámetro; tras ello, luego de permitir o inducir la evaporación del disolvente, la placa se introduce ligeramente inclinada dentro de un recipiente o cámara de elución que contiene la fase móvil, que es un disolvente que asciende por capilaridad por el lecho de la placa (el nivel del mismo no debe de rebasar en altura al de las muestras de la mezcla que han sido colocadas sobre la placa). La disposición de la cámara es como la que se muestra en la Figura superior. Los diferentes eluatos se separarán de esta manera en base a sus diferentes afinidades entre las dos fases al ir migrando a lo largo de la placa impulsados por la fase móvil. La cámara se mantiene cerrada para que su atmósfera se sature en los vapores del eluyente con el objeto de facilitar su ascenso, evitando pérdidas por evaporación y manteniendo un flujo regular. Como fases estacionarias se han empleado gel de sílice, celulosa, alúmina (óxido de aluminio), gel de sílice químicamente modificada, poliamidas, etc. Las placas ordinarias (cuya apariencia durante la evolución de la separación tienen un aspecto similar aspecto que se muestra en la Figura inferior) poseen un grosor de fase estacionaria de 200 a 250 μm de espesor con partículas de 20 μm o más; las de alto rendimiento cuentan con espesores de fase estacionaria de 100 μm de espesor y partículas de 5 mm o menos (de aquí el nombre de capa delgada o fina). El desplazamiento de un eluato se cuantifica en términos de su Rf o factor de retardo (Figura inferior), la relación entre la trayectoria recorrida por cada eluato entre la que ha recorrido el frente del disolvente. Algunos expertos recomiendan que solamente se permita al disolvente recorrer a lo sumo dos terceras partes de la placa, pero es posible dejar que el disolvente ascienda más sin que los resultados se vean afectados y, de hecho, esto permite una mejor resolución de los componentes de la mezcla. La cromatografía de capa delgada se ha empleado extensamente en química (donde cabe destacar la química de productos naturales), bioquímica, toxicología, ciencias ambientales, ciencias de los alimentos, etc. Nombre alternativo: cromatografía en capa delgada. Acrónimo: CCD, CCF.
En inglés: thin layer chromatography.
| 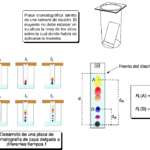 |
| Cromatografía en capa fina | v. Cromatografía en capa delgada
| |
| Cromatografía en papel | Técnica de separación cromatográfica (v. cromatografía) en la que la fase estacionaria es papel. En sí, la disposición del equipo es idéntica a la de la cromatografía en capa delgada (v.), y los principios y la expresión de los resultados (por ejemplo, el factor de retardo) son los mismos.
En inglés: paper chromatography.
| 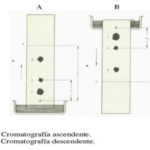 |
| Cromatograma | Diagrama donde se representan los resultados de la separación de una mezcla mediante técnicas cromatográficas. En el eje de las ordenadas se representa el valor medido de alguna propiedad física a partir de la cual se ha detectado la presencia de una sustancia, o bien una unidad relativa que la cuantifica (igualmente basada en la medición de alguna propiedad), mientras que en el de las abscisas el tiempo. En la Figura superior se representa un cromatograma con diferentes máximos, cada uno de ellos asociado a la presencia de uno de los componentes de la mezcla original. En la Figura inferior se indica la manera en la que se mide lo que tarda en abandonar al sistema de separación una de estas sustancias tomando como referencia su máximo (lo que se denomina tiempo de retención, tR), equivalente a la suma del tiempo que tarda en salir del sistema la fase móvil o eluyente (llamado a veces tiempo muerto, tM) y el tiempo efectivo que es retenido cada componente o eluato (o tiempo de retención corregido, tR’ o tS).
En inglés: chromatogram.
| 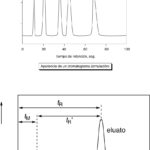 |
| Cromo, trióxido de | Sólido de color rojizo oscuro. Fórmula = CrO3. M = 99.99 g/mol. Se descompone a los 196 ºC. Oxidante. Toxicidad muy elevada. Carcinogénico potente. Soluble en agua. No debe liberarse bajo ninguna circunstancia al ambiente. Se emplea en la preparación del reactivo de Jones (v.) y en la oxidación de Collins (v.). Nombre alternativo: anhídrido crómico, óxido de cromo(VI).
En inglés: Chromium(VI) oxide.
| |
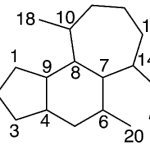
| Crotofolano | Sustancia que posee una estructura molecular básica similar a la imagen.
En inglés: crotofolane.
|  |
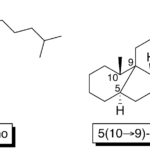
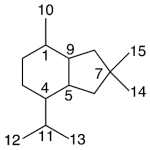
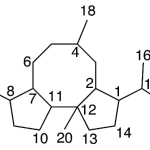
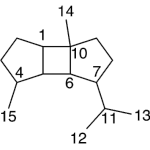
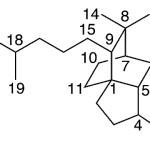
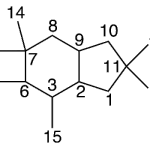
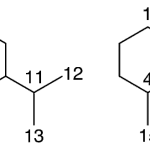
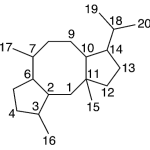
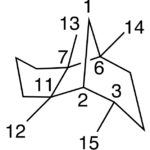
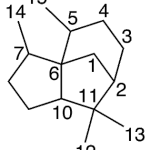
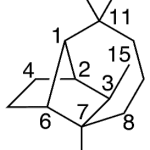
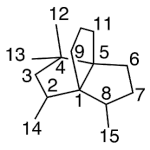
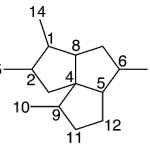
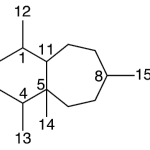
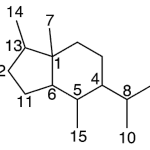
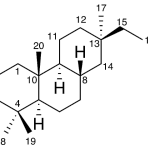
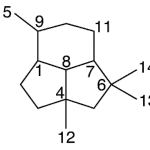
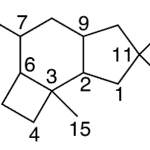
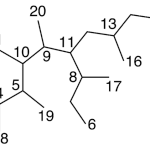
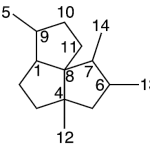
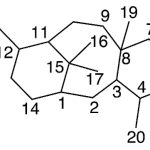
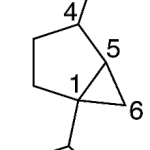
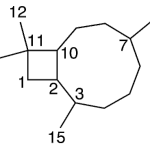
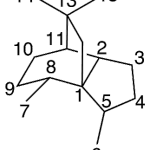
| Cuadrano | Sustancia que posee una estructura molecular básica similar a alguna de las mostradas en la imagen.
En inglés: quadrane.
|  |
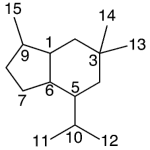
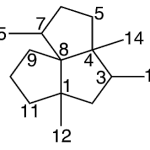
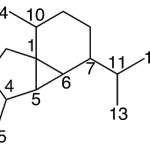
| Cubebano | Sustancia que posee una estructura molecular básica similar a la imagen.
En inglés:cubebane.
|  |
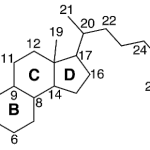
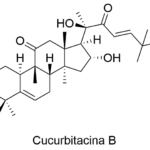
| Cucurbitacina | Nombre de diversos compuestos de naturaleza triterpenoide aislados de diferentes especies de Cucurbitaceae (ejemplo de las cuales es la calabaza, Cucurbita pepo). Constituyen su principio amargo. Un ejemplo es la cucurbitacina B. Algunos de estos compuestos poseen actividad antitumoral.
En inglés: cucurbitacine.
|  |
| Cuparano | Sustancia que posee una estructura molecular básica similar a la imagen.
En inglés: cuparane.
| 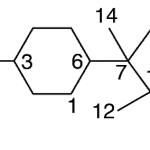 |